国科大杭州高等研究院药学院成果登上Science
北京时间11月21日凌晨,国科大杭州高等研究院(以下简称“杭高院”)药物科学与技术学院(以下简称“药学院”)/中国科学院上海药物研究所(以下简称“上海药物所”)吴蓓丽课题组联合临港实验室朱亚课题组、上海药物所赵强课题组、上海科技大学水雯菁课题组和上海药物所谢岑课题组最新成果——“Noncanonical agonist-dependent and -independent arrestin recruitment of GPR1”在国际顶级学术期刊Science正式发表。

该成果首次全面阐释了阻遏蛋白(arrestin)对趋化素受体GPR1的功能调控分子机制,极大拓展了对GPCR非典型信号转导和调控的认识与理解。首次揭示了GPR1作为“清道夫受体” 的分子全貌,该受体通过阻遏蛋白偏向性信号和脂质辅助的内吞机制精细调控趋化素信号稳态。这些发现不仅拓展了对于GPCR信号转导机理的认识,也为肥胖、代谢性炎症等疾病的精准干预提供了新的线索和潜在靶点。
研究内容:
趋化素(chemerin)是一种重要的脂肪因子,参与调控脂质代谢和胰岛素敏感性,与肥胖、糖尿病等代谢性疾病的发生发展密切相关。同时,趋化素还能介导免疫细胞定向迁移至炎症部位,参与机体抵御病原入侵、维持稳态和修复组织损伤等重要生理过程,在炎症与代谢之间发挥“桥梁”作用。趋化素的生物学效应由其受体介导,包括CMKLR1和GPR1。其中,CMKLR1作为一种典型的G蛋白偶联受体(GPCR),通过G蛋白信号通路驱动脂质代谢与炎症反应,而GPR1则是一种非典型的GPCR,依赖于阻遏蛋白介导的信号通路和受体内吞,清除过量的趋化素。趋化素及其受体通过这种“经典激活—非典型平衡”的双重机制,在代谢平衡和炎症反应调控中发挥关键作用,但相关分子机制一直未被明确阐明。

吴蓓丽研究团队
吴蓓丽团队联合其他课题组历经数年研究,综合运用结构生物学、质谱技术和细胞功能评价系统揭示了趋化素受体信号转导的分子机制,相关研究将为肥胖和糖尿病等代谢性疾病的药物发现奠定重要基础。
被趋化素激活后,GPR1通过至少四种方式与β-arrestin 1结合,体现了两者从“预结合”到“稳定结合”状态的动态过程。这是首次在原子水平阐明一种GPCR与阻遏蛋白相互作用的动态调控模式,为理解阻遏蛋白介导受体脱敏及内吞的分子机制提供了重要信息,同时也提出了靶向多种构象状态开展药物研发的必要性,将促进开发特异性靶向阻遏蛋白信号通路的新型偏向性药物。
GPR1与β-arrestin 1和β-arrestin 2的结合能力相近,但两种阻遏蛋白对GPR1信号转导和生理功能的调控作用不同。研究结果显示,不同于β-arrestin 1通过多种方式与GPR1结合,β-arrestin 2与GPR1结合时,主要采取一种有助于受体内吞和信号转导的结合模式,这些不同的作用模式可能为两种阻遏蛋白迥异的调控作用提供了分子基础。
此外,研究还发现细胞膜的一种主要脂质成分——胆固醇对于GPR1与β-arrestin 2的结合至关重要,该脂分子通过与两者同时作用稳定复合物的构象,而对于β-arrestin 1的结合则没有影响。这些发现促进了对于两种阻遏蛋白在GPCR信号转导中功能分化的认识,并为靶向特定阻遏蛋白介导的信号通路研发新型药物提供了线索。
包括GPR1在内的众多GPCR不仅可被激动剂激活后内吞,还可在非激活状态下内吞,这是GPR1清除不同活性趋化素(激活型趋化素和非激活型趋化素)以维持其功能动态平衡的关键机制,但相关分子机理不明。研究人员通过结构和功能研究发现,不与趋化素结合时,GPR1的构象处于非激活状态,这使β-arrestin 1通过一种全新的模式与其结合。质谱分析的结果显示,非激活的GPR1的C端区域具有较高的基底磷酸化水平,促进了受体对阻遏蛋白的招募及其内吞。
同时发现内源性脂肪酸——棕榈油酸和棕榈酸通过介导非激活态GPR1与β-arrestin 1的结合,协助GPR1在没有激动剂激活的状态下内吞,提示该类脂分子对于GPR1清除非激活型趋化素发挥调控作用。研究人员进一步检测脂肪细胞中的脂质含量,发现在高脂环境下CMKLR1促进脂肪代谢,降低了脂质积累,而GPR1通过清除非激活型趋化素促进CMKLR1激活,从而辅助脂质代谢。
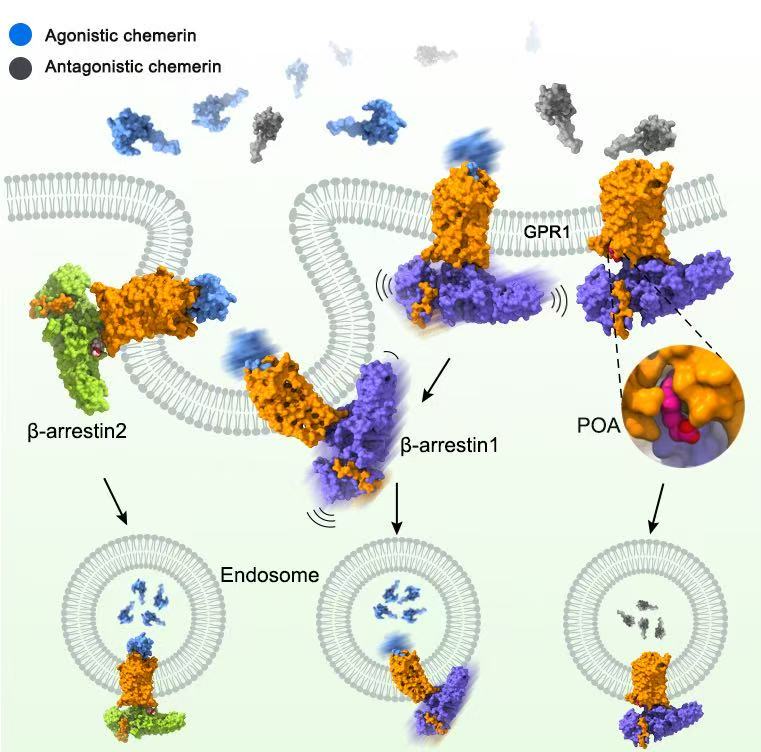
GPR1与阻遏蛋白的复合物结构示意图(吴蓓丽研究组提供)
趋化素受体GPR1在脂肪代谢和炎症反应中发挥重要作用,是肥胖和炎症的潜在药物作用靶点。图中GPR1与阻遏蛋白的不同的复合物结构用蛋白质表面图表示,GPR1为橙色,β-arrestin 1和β-arrestin 2分别为蓝色和绿色,激活型趋化素和非激活型趋化素分别为浅蓝色和灰色。
成果应用:
GPCR是目前最重要、应用最广泛的药物作用靶点之一。然而,GPCR信号转导过程复杂且动态,其潜在的分子调控机制尚未被完全揭示,这成为限制相关靶向药物开发的瓶颈。尽管近年来GPCR的结构与功能研究取得了巨大进展,但由于GPCR与阻遏蛋白之间的结合过程具有极高的动态性,因此其研究极具挑战性,这使得学界对于GPCR如何与arrestin实现动态偶联的分子机制缺乏清晰认识。
近年来,杭高院药学院吴蓓丽课题组等研究团队持续攻关,依托在GPCR研究领域长期的深厚积累,通过反复的条件摸索与体系优化,率先成功地描绘了arrestin动态调控GPCR功能的分子图谱。不仅极大地促进了对GPCR信号转导机制的深入理解,也为设计药效更强、毒副作用更低的偏向性药物提供了新的思路,对开发靶向GPCR的原创药物具有重要的科学价值与应用前景。未来,团队将持续深化对趋化素受体偏向性信号转导机制的研究,针对肥胖和代谢性炎症等疾病开发新型药物,为代谢性疾病的精准干预开辟新途径。
这是本学期以来杭高院第二项登上国际顶级期刊的科研成果,连续重磅突破不仅彰显了杭高院聚焦前沿突破的科研优势,更印证了其依托中国科学院顶尖平台、发挥交叉学科特色的独特优势。杭高院始终坚持构筑科教融合新高地,锻造战略科技增长极,短短几年间,在科技成果创新、科研平台建设和体系建设等方面取得了重大突破。多项高水平研究斩获 CNS 三大顶刊发文:登上Cell的成果“成体肺脏中新生肺泡上皮干细胞的再生起源”入选2024年度“浙江十大科技事件”;登上Nature的成果破解世界化工百年难题,受到期刊四位主审稿人的高度评价。同时,参与攻关研制的空间窄线宽激光器和空间飞秒光梳随“梦天舱”一同升空,建立世界上第一套空间冷原子钟组;接收落户浙江首份“嫦娥五号”月壤,稳步推进相关载荷研究及验证试验;牵头承担研制巴基斯坦遥感卫星02星主载荷,载荷已成功在轨开机成像,科技创新核心能力持续跃升。
文章信息:
该研究论文的第一作者包括临港实验室博士生蔡恒,杭高院博士生林晓文、赵乐琛和何茂洲副研究员,上海科技大学博士生余洁和张冰洁副研究员,上海药物所博士生马元娣。杭高院为该工作的第一完成单位。该研究获得国家重点研发计划、国家自然科学基金、中国科学院战略性先导科技专项、上海市“科技创新行动计划”、杭高院青苗项目等经费支持。
全文链接:https://www.science.org/doi/10.1126/science.adt8794