新研究实现对酵母蛋白翻译水平的精细调控
华东理工大学生物工程学院教授蔡孟浩课题组通过对工业菌株毕赤酵母基因组的系统分析,发现了编码基因上游5’非翻译区(5UTR)区的作用规律,并据此设计了一系列合成生物学元件,实现了对蛋白翻译水平的精细调控。近期,相关研究成果发表于《代谢工程》。
作为重要的工业菌株,非常规酵母和丝状真菌在制药、食品、生物炼制、酶制剂、化学品和生物材料等工业领域得到广泛应用。尽管CRISPR-Cas9衍生技术有效解决了基因编辑问题,但这些菌株的深度重编程仍受限于遗传背景不清晰和分子工具不足。
巴斯德毕赤酵母是一种Crabtree阴性菌株,生长密度高且具有较强的蛋白表达能力。研究团队发现,5UTR在不同酵母中呈现不同的作用规律。其中,毕赤酵母的5UTR中,基因正义链上游的‘G’频率显著下降,可能与其强蛋白表达能力相关。实验结果显示,人工调整5UTR中的‘G’含量可调节基因表达强度,而优选三核苷酸单元KZ3对基因表达起到了主导作用。
进一步地,研究团队构建了128种KZ3变体,其中58种KZ3变体的基因表达高于天然KZ3序列。研究团队将工程化的5UTR与KZ3重新组合,有效提高了工业蛋白的重组表达能力。同时,通过组合及原位精细调控多酶途径基因表达,显著提升了化工平台化学品3-羟基丙酸的合成能力。
系列研究结果表明,重构设计的5UTR-KZ3序列可招募更多的核糖体到mRNA上增强了翻译水平,而未显著影响基因转录水平。值得一提的是,通过使用已构建的5UTR-KZ3变体或在体内原位进行核苷酸编辑,设计5UTR-KZ3短序列,甚至仅使用KZ3,即可调控基因表达强度。此外,5UTR的CRISPR-Cas9可编辑位点分布广泛,为体内的规模化原位编辑提供了可能。
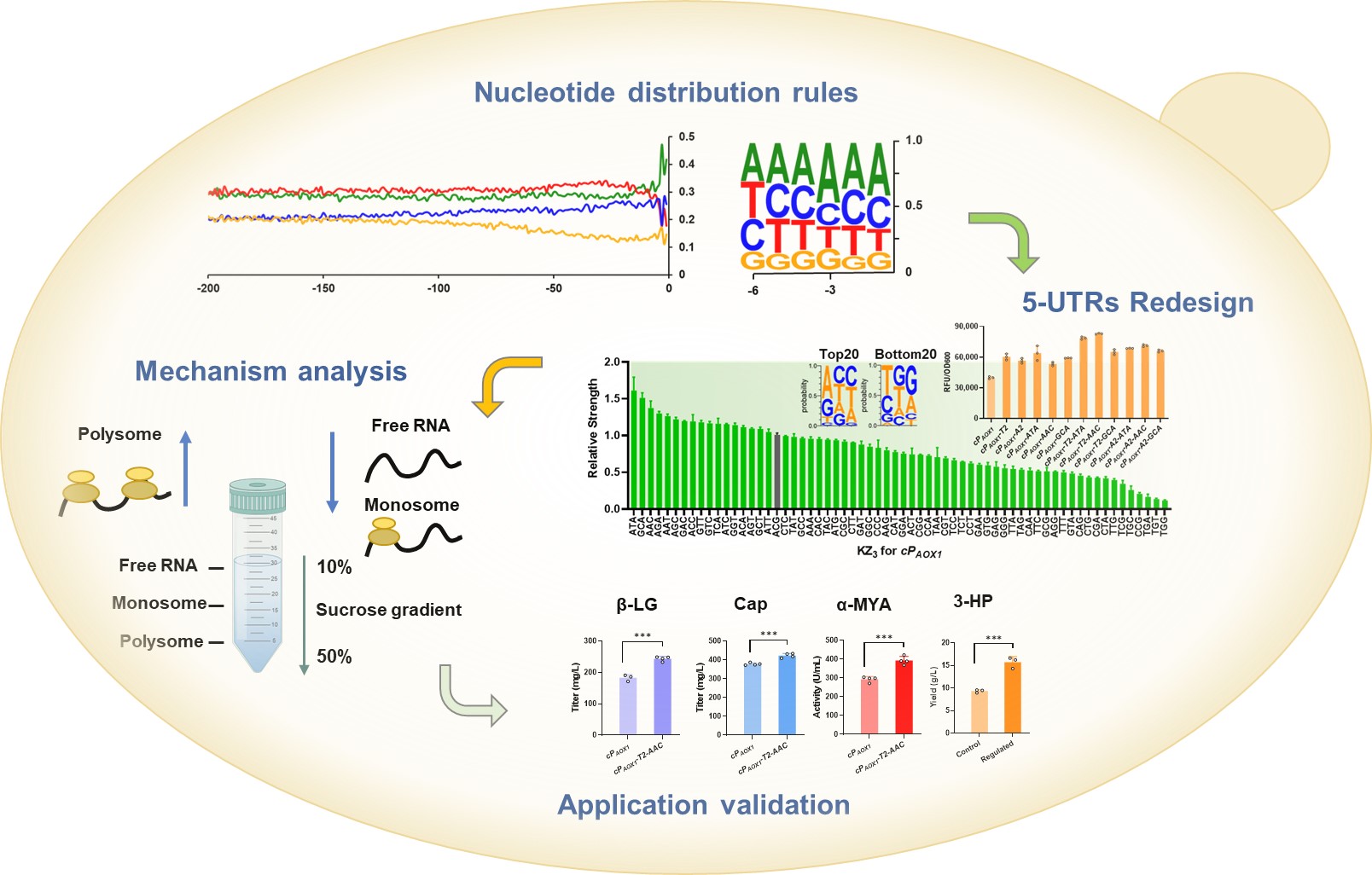
毕赤酵母基因组规模5UTRs碱基分布规律分析及理性调控设计。图片由研究团队提供
研究团队表示,此项研究中的方法同样适用于其他非模式生物样本。结合快速发展、成本降低的DNA合成技术,以及高效的无标记基因编辑技术,该策略在各种研究和工业场景中均具有很好的可行性,为代谢工程和合成生物学研究提供了新工具。(来源:中国科学报 江庆龄)