烯烃碳镁化反应构筑手性季碳
2026年2月11日,中国科学院上海有机化学研究所施世良团队在Nature Chemistry期刊上发表了一篇题为“Contra-electronegativity transmetallation unlocks alkene carbomagnesiation to access quaternary stereocentres”的研究成果。
该成果报道了一种非常规的反电负性转金属化策略,实现了烯烃和丁二烯的区域选择性和对映选择性碳镁化反应,为各种手性季碳的高立体选择性、模块化合成开辟了普适性的新途径。论文通讯作者是施世良研究员;第一作者是叶小东博士和孙博博士。
格氏试剂是有机合成化学领域荣获诺贝尔奖的里程碑式成就,它实现了碳-碳键构建的革命性突破,至今在学术界与工业界仍不可或缺。但其传统合成依赖镁对有机卤化物的自由基插入,难以高效制备结构复杂的有机镁试剂——尤其是含有季碳中心或邻近手性中心的结构,这限制了其在复杂手性分子合成中的应用(图1A)。过渡金属催化的烯烃碳镁化反应通过同时构建碳-碳键和碳-镁键,提供了步骤经济的替代路径,然而该方法长期受限于狭窄的底物范围(通常需张力环烯烃或特定烷基镁试剂),并易受迁移插入缓慢、β-H消除、聚合等副反应影响;尤其是对映选择性碳镁化的发展仍主要局限于特定环状烯烃,使得从丰富、非活化的烯烃直接合成立体化学可控、含季碳立体中心的格氏试剂成为一项严峻挑战(图1B)。季碳结构在生物活性分子中广泛存在,其高效、立体选择性构建仍是有机合成中的核心难题,从易得烯烃出发进行模块化不对称合成的方法尤其匮乏。
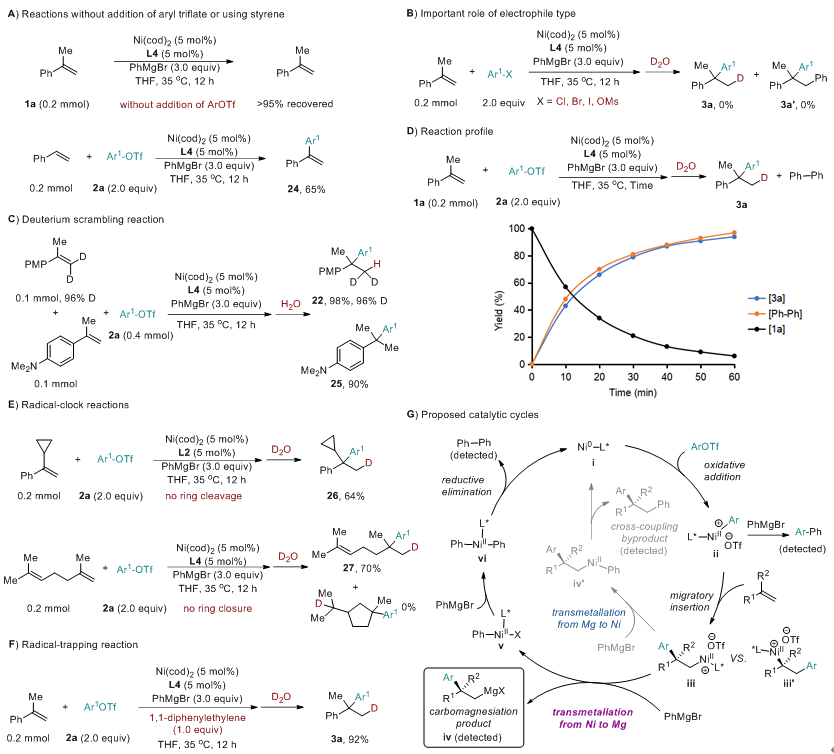
另一方面,传统过渡金属催化交叉偶联反应中的转金属化通常遵循从电正性金属(如Mg,χ=1.31)向电负性更强金属(如Ni,χ=1.91)的方向进行。与此相反,反电负性转金属化——即从电负性金属向电正性金属(如Ni到Mg)的转移——在热力学上往往不利。因此,在过渡金属催化偶联反应体系中长期未被充分探索与利用(图1C)。
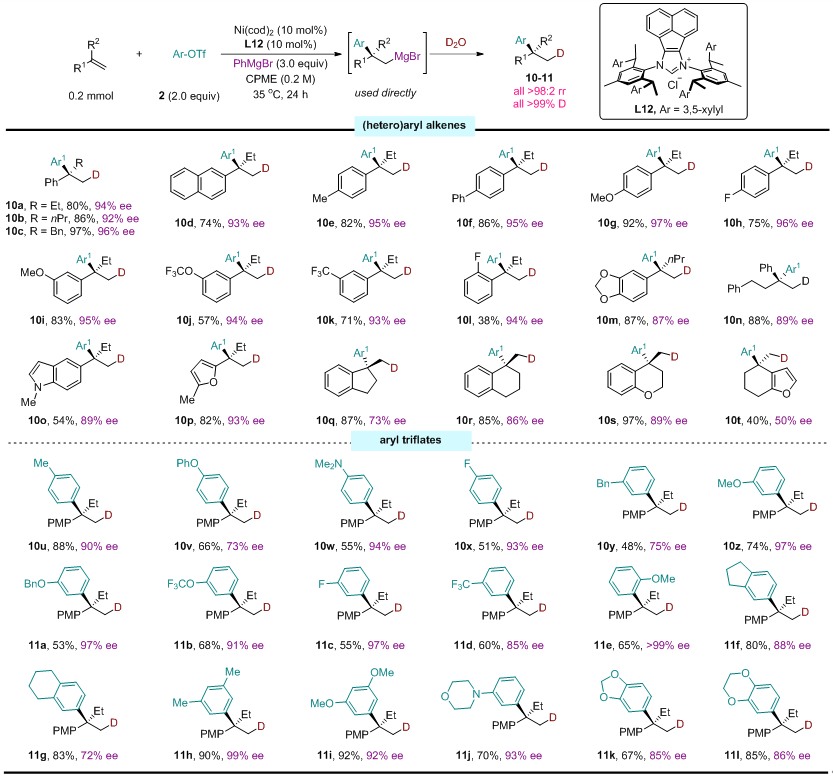
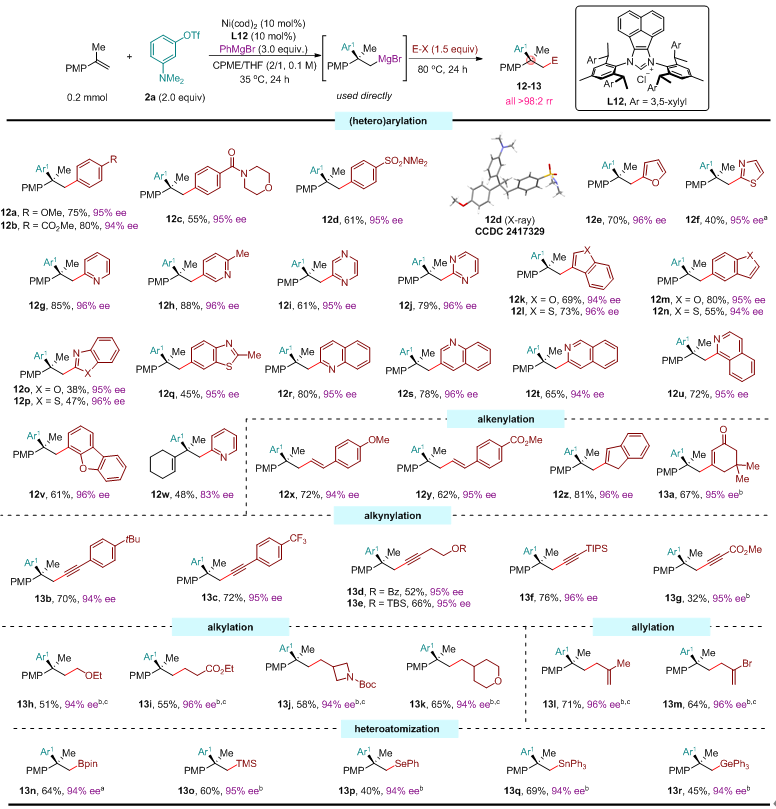
近日,中国科学院上海有机所施世良团队报道了镍催化碳镁化策略,通过非常规的反电负性转金属化过程(镍向镁转移),同步攻克了上述难题。该策略以芳基三氟甲磺酸酯和苯基溴化镁分别作为碳源和镁源,通过对1,1-二取代烯烃和1,3-二烯烃的碳镁化反应,实现了β-季碳格氏试剂的高效、模块化合成。所得有机镁试剂可与多种亲电试剂进行一锅法反应,从而精准地构建结构复杂的季碳中心。该方法利用新颖的、非常规的反电负性转金属化过程,为高立体选择性、模块化合成结构复杂的格氏试剂和季碳立体中心开辟了新的途径(图1D-E)。
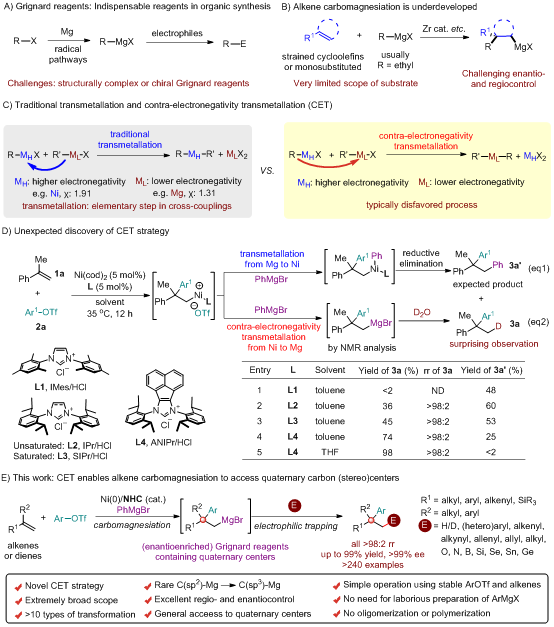
图1:反电负性转金属化驱动的烯烃碳镁化反应构筑季碳立体中心。
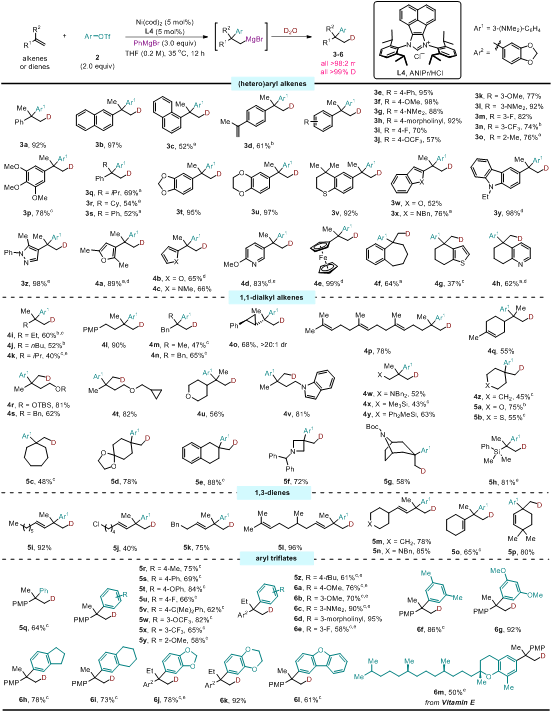
图2:碳镁化消旋反应底物的普适性研究。
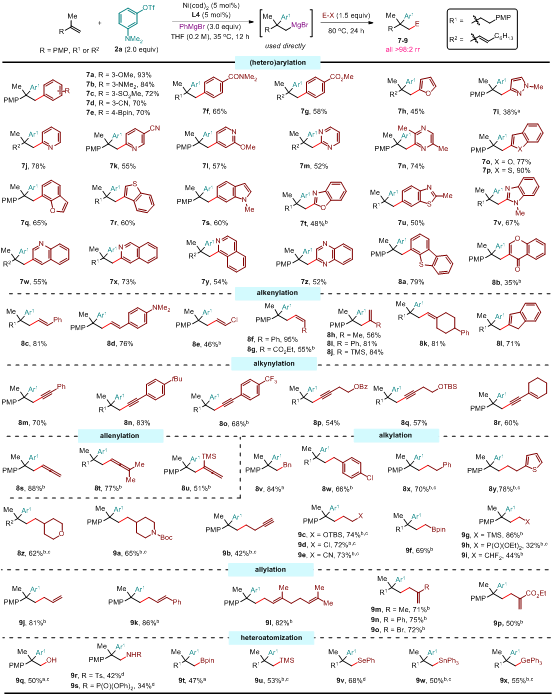
图3:亲电试剂的普适性研究。
图4:不对称碳镁化反应烯烃和三氟甲磺酸酯的普适性研究。
图5:不对称碳镁化反应亲电试剂的普适性研究。
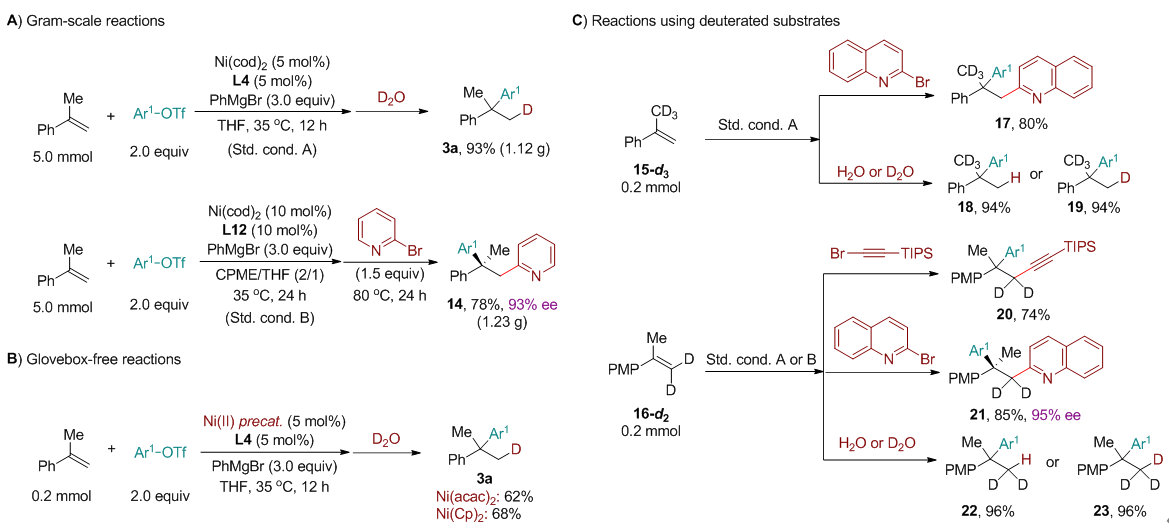
图6:合成应用研究。
图7:机理研究。
总之,施世良团队通过高区域选择性(及对映选择性)的镍催化反应,实现了1,1-二取代烯烃及1,3-二烯烃的碳镁化反应,从而成功合成带有β-季碳(立体)中心的格氏试剂,其可与多种亲电试剂发生反应。该方法采用大位阻NHC-镍催化剂与醚类溶剂的组合,从而实现非常规的反电负性金属转移过程。此外,所设计的手性大位阻NHC配体确保了优异的对映选择性与区域控制性。这一反电负性金属转移策略有望显著拓展碳金属化反应的研究范畴,并为发展新型交叉偶联化学带来新的机遇。(来源:科学网)